Distrofias hereditarias de retina
Revisado por Dr Philippa Vincent, MRCGPÚltima actualización por Dr Colin Tidy, MRCGPÚltima actualización 21 Jul 2023
Satisface las necesidades del paciente directrices editoriales
- DescargarDescargar
- Compartir
- Idioma
- Debate
Profesionales médicos
Los artículos de referencia profesional están diseñados para uso de los profesionales de la salud. Están escritos por médicos del Reino Unido y basados en pruebas de investigación y directrices británicas y europeas. Puede que le resulte más útil el artículo Problemas visuales, o alguno de nuestros otros artículos sobre salud.
En este artículo:
Seguir leyendo
Visión general1
Las distrofias hereditarias de retina son un amplio grupo de trastornos oculares hereditarios que provocan una pérdida visual irreversible. Se desarrollan debido a mutaciones en uno o más genes que provocan la muerte de las células fotorreceptoras de la retina. Se sabe que las mutaciones en más de 200 genes están asociadas a todas las formas diferentes de trastornos de la retina.
Las vías terapéuticas que se están investigando para estos trastornos incluyen la terapia génica para sustituir el gen defectuoso, el tratamiento con factores neurotróficos para estimular el crecimiento de los fotorreceptores, la terapia de sustitución celular y los dispositivos protésicos que pueden captar la luz y transmitir señales eléctricas al cerebro a través de las neuronas de la retina. Para obtener un beneficio óptimo, puede ser necesaria una combinación de enfoques que incluyan tanto la sustitución génica como la celular.
La retinosis pigmentaria es la distrofia retiniana más frecuente y afecta a 1 de cada 3.000 individuos. La mayoría de las mutaciones de la retinosis pigmentaria afectan selectivamente a los bastones. Véase el artículo separado sobre retinosis pigmentaria.
A diferencia de la retinosis pigmentaria, en la que la degeneración de los bastones afecta inicialmente a la retina periférica, muchas distrofias hereditarias de retina afectan principalmente a la mácula. Las distrofias maculares se caracterizan por una pérdida gradual de la agudeza visual, de la visión de los colores y de la sensibilidad al contraste, que suele aparecer en la segunda década de la vida. Existe una variedad de nombres (que a menudo se solapan).
El diagnóstico correcto es importante, ya que determina el pronóstico esperado. Se está evaluando la terapia génica específica para varias enfermedades.2
Anatomía de la retina
La retina es una estructura de muchas capas y las distrofias retinianas pueden afectar a cualquiera de ellas. Desde el vítreo hasta la coroides, estas capas son la membrana limitante interna, la capa de fibras nerviosas, la capa de células ganglionares, la capa plexiforme interna, la capa nuclear interna, la capa plexiforme externa, la capa nuclear externa, la membrana limitante externa, los segmentos interno y externo de los conos y bastones y el epitelio pigmentario de la retina (EPR).
La mácula tiene una alta densidad de conos, células ganglionares y pigmento dentro de las células bipolares y ganglionares. El área central de 1,5 mm de la mácula es la fóvea. Dentro de la fóvea hay una zona avascular aproximadamente circular, la zona avascular foveal, que sólo contiene conos.
Anatomía de la retina
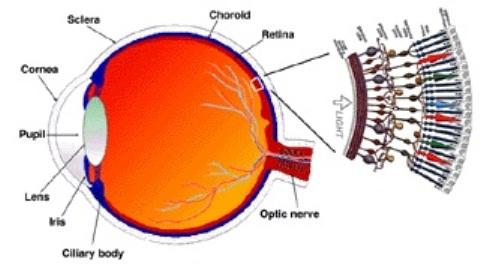
Vía Wikimedia Commons
Seguir leyendo
Síntomas de las distrofias hereditarias de retina (presentación)2
Esto varía en función de la enfermedad. En la retina hay entre 60 y 125 millones de bastones y entre 3,2 y 6,5 millones de conos. En la fóvea no hay bastones, aunque la mayor densidad de bastones se encuentra a una distancia de unos 20° de la fóvea. Los conos se concentran principalmente en la fóvea y están más densamente empaquetados dentro de la foveola. Por lo tanto, las enfermedades que afectan a los bastones tienden a causar problemas visuales nocturnos, así como defectos periféricos del campo visual. Las enfermedades que afectan a los conos provocan un aumento de la sensibilidad a la luz, pérdida de la visión central, alteración de la visión de los colores y defectos del campo visual central.
Diagnóstico2
Por lo general, el diagnóstico se realiza mediante examen clínico y pruebas subjetivas, aunque necesita confirmación con pruebas electrodiagnósticas. Esto ayuda a diferenciar la enfermedad retiniana de la coroidea y contribuye a garantizar la exactitud del diagnóstico (importante a la vista de las implicaciones genéticas).
La fundoscopia -también con luz libre de rojo-, las pruebas de campo visual, las pruebas electrofisiológicas y los electrorretinogramas multifocales (ERG) y las pruebas que evalúan la visión de los colores pueden ayudar al diagnóstico.
Pruebas subjetivas de retina
Pruebas de visión cromática: las más conocidas son las placas de prueba de Ishihara, que distinguen entre el daltonismo rojo y el daltonismo verde. Otras pruebas más sofisticadas pueden evaluar el daltonismo amarillo, así como ayudar a diagnosticar grados complejos y sutiles de daltonismo.
La adaptometría oscura es útil en pacientes que se quejan de ceguera nocturna (nictalopía), que suele ser una característica de estos trastornos.
Evaluación objetiva de la retina
La angiografía con fluoresceína puede ayudar a diferenciar la enfermedad retiniana de la coroidea.
Los ERG registran el potencial de acción producido por la retina en respuesta a la luz y muestran patrones típicos en condiciones de oscuridad (escotópicas) y luz (fotópicas). Las desviaciones de las ondas normales ayudan al diagnóstico de forma similar a un ECG. Durante la prueba, se coloca un electrodo en la córnea para medir las respuestas eléctricas de la retina a la luz.
Los electrooculogramas (EOG) complementan las mediciones ERG. Miden el potencial permanente entre la córnea eléctricamente positiva y la parte posterior del ojo eléctricamente negativa. Un EOG anormal surge como resultado de problemas en el RPG.
Se están evaluando nuevos métodos, como la tomografía de coherencia óptica de alta resolución con dominio espectral (SD-OCT) y la autofluorescencia del fondo del ojo.
Pruebas genéticas2
Las pruebas genéticas convencionales serían costosas y requerirían mucho tiempo, ya que en la diversa gama de distrofias están implicadas mutaciones en más de 200 genes. Los nuevos métodos de pruebas genéticas ofrecen la posibilidad de analizar múltiples genes. Estos métodos permiten realizar análisis mucho más rápidos y rentables.
Seguir leyendo
Tratamiento y gestión de las distrofias hereditarias de retina 2 3
El tratamiento se centra en el diagnóstico y el asesoramiento genético especializado. Las opciones de tratamiento son limitadas y tienden a concentrarse en torno a la rehabilitación visual optométrica (por ejemplo, uso de ayudas para la baja visión, entrenamiento en orientación y movilidad). También se está trabajando en el campo de la terapia molecular y génica, ya que cada vez se identifican más los genes responsables.
La disponibilidad y prestación de los servicios multidisciplinares altamente especializados que necesitan los pacientes varían en todo el Reino Unido.
Hay investigaciones prometedoras en el campo de la terapia génica; por ejemplo, en la amaurosis congénita de Leber, asociada a la disfunción y degeneración de los fotorreceptores, los estudios han demostrado algunos efectos positivos de la terapia génica.
Ejemplos de trastornos hereditarios de la retina4
Existen diversas distrofias hereditarias de retina, algunas de ellas muy raras. Se caracterizan por la pérdida de agudeza visual. Estas enfermedades son una de las principales causas de discapacidad visual grave y afectan a pacientes de todas las edades. Varían tanto a nivel genético como clínico, histológico y fisiopatológico. La investigación genética en curso sigue cambiando la comprensión de la fisiopatología.
Enfermedad de Stargardt y fondo de ojo flavimaculado2
Se ha cuestionado si se trata de dos enfermedades o de una sola. La enfermedad de Stargardt o fundus flavimaculatus es una forma progresiva de degeneración macular juvenil con heterogeneidad clínica y genética. Las mutaciones en al menos cuatro genes son responsables de características clínicas similares y no existe una distinción diagnóstica clara entre ellas. La enfermedad de Stargardt y el fundus flavimaculatus se tratan aquí como una sola entidad.
La enfermedad de Stargardt, con o sin fundus flavimaculatus, es la distrofia hereditaria más frecuente que afecta a la retina central, y se da en 1 de cada 8.000-10.000 personas.5
Descripción - también conocida como distrofia macular juvenil: es una de las dos formas más comunes de degeneración macular hereditaria. Representa el 7% de todas las distrofias retinianas. Descrita por primera vez por el oftalmólogo alemán Karl Stargardt en 1909, se trata de una distrofia macular atrófica bilateral y progresiva caracterizada por "manchas sucias gris-amarillas" perimaculares y periféricas (fundus flavimaculatus).
Herencia: principalmente autosómica recesiva; existe una variante autosómica dominante poco frecuente.
Presentación - desde la infancia (alrededor de los 6 años) hasta los primeros años de la edad adulta: disminución bilateral (normalmente) de la visión central. Suele ser desproporcionada en relación con el cuadro clínico. También hay daltonismo progresivo.
Pronóstico: generalmente malo. La mayoría de los pacientes experimentan un rápido deterioro de la visión durante las dos primeras décadas de vida. Una vez que la visión cae por debajo de 6/12, la progresión es rápida y el pronóstico visual es malo. La rehabilitación visual puede lograr y mantener cierto grado de independencia.6
Una variante que se ha denominado fundus flavimaculatus se presenta más tarde y la mácula puede estar intacta. El paciente puede presentar un deterioro visual central. El deterioro de la visión de los colores puede no notarse hasta más tarde. La distribución y el número de manchas amarillentas pueden cambiar con el tiempo. El pronóstico suele ser mejor y la visión periférica y nocturna no se ven afectadas.
Enfermedad de Best juvenil (distrofia macular viteliforme de Best)2
La enfermedad de Best fue identificada por Friedrich Best en 1906 y es la segunda distrofia hereditaria más frecuente de la mácula.
Descripción - se caracteriza por una acumulación anormal de lipofuscina a nivel del RPG. Ésta crece a lo largo de los años, dando lugar finalmente a un aspecto característico de yema de huevo redonda y que puede asociarse posteriormente a un pseudohipopión.
Herencia - Se trata de una enfermedad hereditaria autosómica dominante progresiva con penetrancia variable entre los distintos miembros de una misma familia. La mutación se ha localizado en el gen BEST1 (VMD2) del cromosoma 11.
Presentación: los síntomas pueden comenzar en las dos primeras décadas de vida. La agudeza visual se deteriora cuando se rompe la "lesión en yema de huevo". Se producen cambios en las lecturas EOG en los niños antes de que sean sintomáticos. La visión puede disminuir sólo ligeramente en la infancia y la adolescencia cuando está presente la "lesión en yema de huevo". Normalmente, la visión no se ve afectada de forma significativa hasta la quinta década.
Pronóstico: la disminución de la agudeza visual puede ser un reflejo de la cicatrización macular, pero otras complicaciones pueden agravarla (por ejemplo, la formación de agujeros maculares o el desprendimiento de retina). Algunos pacientes llegan a padecer una discapacidad visual grave, pero la mayoría conservan la capacidad de lectura con visión en un ojo.
Distrofia foveomacular viteliforme del adulto (degeneración viteliforme del adulto)2 7
Descripción - en esta enfermedad, hay lesiones bilaterales y simétricas dentro de la mácula. Son similares a las de la enfermedad de Best, pero son más pequeñas, se presentan en la edad adulta y no progresan.
Herencia: probablemente autosómica dominante.
Presentación - 40-50 años: visión borrosa ± distorsión de las imágenes (metamorfopsia) que puede ser leve hasta el punto de que esta afección se descubre a menudo por casualidad.
Pronóstico: bueno, a menos que se produzcan complicaciones (como la neovascularización de la coroides subyacente).
Otras distrofias maculares hereditarias4
La distrofia macular pseudoinflamatoria de Sorsby, la distrofia macular de Carolina del Norte y el edema macular cistoide dominante tienen mal pronóstico.
La distrofia macular de mariposa es una afección relativamente inocua (a menudo descubierta por casualidad) que provoca una alteración leve de la visión central.
La distrofia de patrón se presenta con distorsión paracentral y pérdida de agudeza visual. También puede ser asintomática. Se observan pequeñas manchas amarillas en todo el fondo de ojo, con atrofia macular asociada.
Acromatopsia8
Descripción - esta enfermedad provoca la pérdida completa de la función de los conos, mientras que la función de los bastones es normal a lo largo del curso de la enfermedad. Se estima que su prevalencia es de aproximadamente 1:30.000. Dado que los conos se concentran en la fóvea, la mácula y la fóvea se ven afectadas de forma desproporcionada.
Herencia: la acromatopsia congénita se transmite de forma autosómica recesiva.
Presentación - los pacientes se presentan en la primera infancia con nistagmo, comportamiento visual anormal o fotofobia. La agudeza es inferior a 20/200. La fundoscopia es anodina. Los campos visuales muestran un escotoma central relativo. La ERG es la herramienta más útil para evaluar la función. Muestra que la función de los conos está ausente mientras que la de los bastones es normal. Se han detectado mutaciones en varios genes que causan acromatopsia.
Pronóstico: no hay progresión ni tratamiento, salvo el apoyo a la baja visión. La terapia génica ha demostrado ser prometedora: se ha conseguido restaurar la función de los conos en modelos animales con similitudes al fenotipo humano, utilizando terapia de sustitución génica mediada por virus con diferentes formas de un promotor de opsina de cono rojo.
Retinosquisis ligada al cromosoma X2
Descripción y herencia - se trata de una enfermedad recesiva ligada al cromosoma X, causada por mutaciones del gen RS1, que codifica la proteína retinosquisis. El resultado es la retinosquisis, o división de las capas de la retina, normalmente en la capa plexiforme externa. La parte afectada de la retina tendrá una visión subóptima.
Presentación: afecta casi exclusivamente a varones jóvenes. La prevalencia se estima en torno a 1:15.000-1:30.000. La retinosquisis periférica se observa en aproximadamente la mitad de los pacientes. La retinosquisis foveal está presente en casi todos los pacientes y puede observarse con SD-OCT, que muestra espacios quísticos dentro de la retina. La visión central puede estar deteriorada, con una agudeza visual que oscila entre 20/30 y menos de 20/200. La pérdida de agudeza se debe a la formación de pequeños quistes entre las capas separadas de la retina. Estos quistes suelen formar una rueda de radios. La visión periférica también puede perderse si la capa interna de células nerviosas se separa de la capa externa de células.
Pronóstico - recientemente, la administración tópica de los inhibidores de la anhidrasa carbónica dorzolamida y brinzolamida demostró ser eficaz para reducir los quistes maculares en pacientes con retinosquisis ligada al cromosoma X.
Drusas familiares (distrofia macular de Carolina del Norte)9
Descripción - se cree que esta enfermedad (con subtipos conocidos como coroiditis en panal de Doyne o malattia leventinese) es una forma precoz de degeneración macular asociada a la edad. Se caracteriza por la aparición de manchas de color amarillo cremoso bien definidas (drusas) sobre la mácula, que con el tiempo pueden extenderse ampliamente por el polo posterior del ojo y alrededor del disco óptico.
Herencia: autosómica dominante con penetrancia completa pero expresividad variable.
Presentación: las drusas no suelen ser visualmente problemáticas hasta alrededor de la quinta década de vida y los pacientes experimentan entonces un deterioro visual central.
Pronóstico: se trata de una enfermedad progresiva, pero se conserva la visión periférica.
Distrofia cristalina de Bietti10
Descripción - esta enfermedad se caracteriza por depósitos cristalinos en la córnea periférica y la retina. Puede ir acompañada de una atrofia progresiva de la retina.
Herencia: ligada al cromosoma X o autosómica recesiva.
Presentación - hay una pérdida visual progresiva en la tercera década, en particular de la visión periférica y nocturna.
Pronóstico: el ritmo de progresión varía de un individuo a otro.
Distrofias progresivas de los conos11
Descripción: este grupo de trastornos poco frecuentes abarca una serie de problemas que van desde la disfunción pura de los conos hasta los que presentan diversos grados de disfunción asociada (pero normalmente menos grave) de los bastones. Muchos pacientes empiezan con un problema puramente de conos que, con el tiempo, afecta progresivamente a los bastones. Su incidencia estimada oscila entre 1 de cada 20.000-100.000.
Herencia - la mayoría son esporádicas, pero también se conoce la herencia autosómica dominante, autosómica recesiva y ligada al cromosoma X.
Presentación - pérdida visual bilateral, lenta y progresiva (visión nocturna mejor que la diurna), fotofobia, mala visión de los colores ± nistagmo. También puede haber defectos asociados del campo visual.
Pronóstico - A corto plazo, los que tienen menos afectación de la varilla evolucionan bien, pero, en última instancia, el pronóstico es malo.
Síndrome de Alport12
El síndrome de Alport es un trastorno genético que afecta a 1 de cada 5.000 niños y provoca glomerulonefritis, insuficiencia renal terminal y pérdida auditiva neurosensorial. Puede afectar a los ojos.
Descripción - la enfermedad afecta a la síntesis de colágeno de tipo IV y da lugar a anomalías de la membrana basal que se manifiestan a través de una enfermedad renal crónica y, a veces, con sordera neurosensorial. A menudo se observan diversas anomalías oculares, como lenticonus (cristalino en forma de cono), queratocono, cataratas y manchas retinianas en la mácula y la periferia media. Rara vez ponen en peligro la visión.
Herencia: dominante ligada al cromosoma X.
Presentación - con problemas renales y, aunque no invariablemente, sordera neurosensorial.
Pronóstico - el pronóstico visual es bueno; la agudeza no suele verse afectada. El lenticono puede tratarse mediante la sustitución del cristalino, como en el caso de las cataratas. El queratocono leve puede tratarse con lentes de contacto duras o piggy-back; los casos graves pueden requerir un trasplante de córnea.
Retina moteada familiar benigna13 14
En esta enfermedad rara, el fondo de ojo está invadido masivamente por lesiones que aparecen como manchas discretas, blancas o amarillas brillantes, situadas muy por detrás de los vasos sanguíneos de la retina. La mácula siempre está intacta. Los estudios con fluoresceína revelan una mácula sana y vasos sanguíneos retinianos y coroideos.
Descripción: lesiones benignas de forma irregular que cubren densamente la retina y se extienden hasta la periferia lejana. Pueden ser de color blanco, amarillo o gris.
Herencia: autosómica recesiva.
Presentación: asintomática, suele descubrirse por casualidad.
Pronóstico: excelente, normalmente la visión no se ve afectada.
Amaurosis congénita de Leber (ACL)15 16 17
La LCA es la más grave de todas las distrofias retinianas. Los individuos afectados suelen presentar en el primer año de vida una discapacidad visual profunda, nistagmo errante, patología retiniana variable y, ocasionalmente, otras patologías sistémicas. Actualmente se sabe que está causada por al menos seis genes. Se ha observado que diferentes mutaciones en varios de estos genes causan retinosis pigmentaria y otras distrofias retinianas. Por lo tanto, se sugiere que el fenotipo de LCA debe ser el resultado de mutaciones que tienen las consecuencias más graves.
La prevalencia estimada es de 1 : 50.000-100.000 - es una causa hereditaria de inicio precoz de deficiencia visual grave en la infancia, caracterizada por una distrofia retiniana grave. Suele presentarse en el primer año de vida.
Descripción - la función visual suele ser deficiente y a menudo va acompañada de nistagmo, respuestas pupilares lentas o ausentes, fotofobia, hipermetropía elevada y queratocono. La agudeza visual rara vez es superior a 20/400.
Herencia: se han asociado variantes en al menos seis genes con la LCA o la retinosis pigmentaria de aparición temprana, lo que da lugar a una herencia genéticamente heterogénea.
Presentación: los niños presentan una discapacidad visual grave desde el nacimiento o en los primeros años de vida. Un hallazgo característico es el "signo oculo-digital de Franceschetti", que consiste en pinchar, presionar y frotar los ojos. El frotamiento constante de los ojos provoca la reabsorción de la grasa orbitaria y el consiguiente endoftalmos (ojos hundidos en las órbitas). Al principio, la retina puede parecer normal, pero más adelante en la infancia suele observarse una retinopatía pigmentaria similar a la retinosis pigmentaria. El ERG es característicamente no detectable o gravemente subnormal.
Pronóstico: el tratamiento es de apoyo. Los niños se benefician de la corrección del defecto refractivo, del uso de ayudas para la baja visión cuando es posible y del apoyo en las oportunidades educativas. En la medida de lo posible, debe disuadirse a los niños de pincharse y presionarse los ojos repetidamente. En aquellos con visión residual, es necesario evaluar periódicamente la ambliopía, el glaucoma o las cataratas. La terapia génica puede ser beneficiosa en el futuro: los ensayos de terapia de sustitución génica han demostrado su eficacia para devolver la vista a perros afectados.18
Ceguera nocturna estacionaria congénita16 19
Se trata de un grupo de enfermedades raras y no progresivas de la retina en las que una función anómala de los bastones provoca alteraciones de la visión nocturna. La mayoría de los casos familiares están ligados al cromosoma X, aunque se ha descrito una dominancia autosómica. Existen síntomas oculares asociados como miopía, hipermetropía, nistagmo y agudeza visual reducida.
Descripción - la prevalencia de esta enfermedad es desconocida pero muy baja. Está presente desde el nacimiento.
Herencia: dependiendo del subtipo, puede ser autosómica dominante, autosómica recesiva o ligada al cromosoma X.
Presentación - mala visión nocturna como resultado de un retraso o una incapacidad para alcanzar los umbrales normales de los bastones adaptados a la oscuridad. Los pacientes presentan ceguera nocturna, agudeza reducida, miopía alta, nistagmo y estrabismo. Existen dos tipos principales: la forma completa y la forma incompleta. La forma completa provoca siempre ceguera nocturna, mientras que la forma incompleta no siempre. Los tipos se distinguen por ERG.
Pronóstico: no hay progresión.
Monocromatismo congénito20
Descripción - se trata de un término genérico utilizado para describir diversos grados de monocromatismo de bastones o de conos. Puede asociarse a trastornos de la función endocrina o hipotalámica y a sordera neurosensorial.
Herencia: según el subtipo, autosómica recesiva o ligada al cromosoma X.
Presentación - daltonismo: si la visión del color está totalmente ausente, el mundo se ve en tonos grises. Puede haber cierta percepción del color en el monocromatismo de bastones incompleto. El monocromatismo de conos se asocia a una mejor agudeza visual (6/6 a 6/9) que el monocromatismo de bastones (cuando es completo, la agudeza visual es del orden de 6/60).
Pronóstico: no hay progresión.
La Dra. Mary Lowth es autora o autora original de este folleto.
Lecturas complementarias y referencias
- Real Instituto Nacional de Ciegos (RNIB)
- Amaurosis congénita de LeberContactar con una familia
- Ziccardi L, Cordeddu V, Gaddini L, et al.; Terapia génica en distrofias de la retina. Int J Mol Sci. 2019 Nov 14;20(22):5722. doi: 10.3390/ijms20225722.
- Solebo AL, Teoh L, Rahi JEpidemiología de la ceguera infantil. Arch Dis Child. 2017 Sep;102(9):853-857. doi: 10.1136/archdischild-2016-310532. Epub 2 de mayo de 2017.
- Brito-García N, Del Pino-Sedeno T, Trujillo-Martín MM, et al.Effectiveness and safety of nutritional supplements in the treatment of hereditary retinal dystrophies: a systematic review. Eye (Lond). 2017 Feb;31(2):273-285. doi: 10.1038/eye.2016.286. Epub 9 de diciembre de 2016.
- Kannabiran C, Mariappan IVías terapéuticas para las formas hereditarias de ceguera retiniana. J Genet. 2018 Mar;97(1):341-352.
- Nentwich MM, Rudolph G; Enfermedades oculares retinianas hereditarias en la infancia y la juventud que afectan a la retina central. Oman J Ophthalmol. 2013 Sep;6(Suppl 1):S18-25. doi: 10.4103/0974-620X.122290.
- Moore T, Burton HGenetic Ophthalmology in Focus: A Needs Assessment & Review of Specialist Services for Genetic Eye Disorders, abril de 2008.
- Rozet JM, Gerber S, Ducroq D, et al.Distrofias maculares hereditarias. J Fr Ophtalmol. 2005 Jan;28(1):113-24.
- Thumann GProspectivas para la terapia génica de las degeneraciones retinianas. Curr Genomics. 2012 Aug;13(5):350-62. doi: 10.2174/138920212801619214.
- Shah M, Zaman M, Khan MT, et al.Rehabilitación visual de pacientes con enfermedad de Stargardt. J Coll Physicians Surg Pak. 2008 mayo;18(5):294-8.
- Do P, Ferrucci SDistrofia foveomacular viteliforme de inicio en la edad adulta. Optometría 2006 abr;77(4):156-66.
- Komaromy AM, Alexander JJ, Rowlan JS, et al.La terapia génica rescata la función de los conos en la acromatopsia congénita. Hum Mol Genet. 2010 Jul 1;19(13):2581-93. doi: 10.1093/hmg/ddq136. Epub 2010 abr 8.
- Zhu Z, Zou H, Li C, et al.; La posible patogénesis de la caldera macular en pacientes con distrofia macular de Carolina del Norte. BMC Ophthalmol. 2022 Nov 19;22(1):447. doi: 10.1186/s12886-022-02655-w.
- Vargas M, Mitchell A, Yang P, et alDistrofia cristalina de Bietti. GeneReviews®, abril de 2012.
- Gill JS, Georgiou M, Kalitzeos A, et al.Progressive cone and cone-rod dystrophies: clinical features, molecular genetics and prospects for therapy. Br J Ophthalmol. 2019 Jan 24;103(5):711-20. doi: 10.1136/bjophthalmol-2018-313278.
- Savige J, Lipska-Zietkiewicz BS, Watson E, et al.Directrices para las pruebas genéticas y el tratamiento del síndrome de Alport. Clin J Am Soc Nephrol. 2022 Jan;17(1):143-154. doi: 10.2215/CJN.04230321. Epub 2021 Dic 20.
- Bin NJ, Heng HM, Poh R, et al.Phospholipase A2 group v in benign familial fleck retina in a set of triplets. Retina. 2015 Jun;35(6):1266-72. doi: 10.1097/IAE.0000000000000446.
- Sabel Aish SF, Dajani BBenign familial fleck retina. Br J Ophthalmol. 1980 Sep;64(9):652-9.
- Francis PJGenética de las enfermedades hereditarias de la retina. J R Soc Med. 2006 Abr;99(4):189-91.
- Pusch CM, Zeitz C, Brandau O, et al.; La forma completa de la ceguera nocturna estacionaria congénita ligada al cromosoma X está causada por mutaciones en un gen que codifica una proteína de repetición rica en leucina. Nat Genet. 2000 Nov;26(3):324-7.
- Weleber RG, Francis PJ, Trzupek KM, et al.Amaurosis Congénita de Leber
- Drack AV, Johnston R, Stone EM¿Qué pacientes con amaurosis congénita de Leber son elegibles para ensayos de terapia génica? J AAPOS. 2009 Oct;13(5):463-5.
- Abramowicz MJ, Ribai P, Cordonnier MCongenital stationary night blindness: report of an autosomal recessive family and linkage analysis. Am J Med Genet A. 2005 Jan 1;132A(1):76-9.
- Jan JE, Tze WJ, Johnston AC, et al.Monocromatismo congénito familiar, cataratas y sordera neurosensorial. Am J Dis Child. 1976 Dic;130(12):1349-50.
Seguir leyendo
Historia del artículo
La información de esta página ha sido redactada y revisada por médicos cualificados.
Próxima revisión prevista: 19 de julio 2028
21 Jul 2023 | Última versión

Pregunte, comparta, conecte.
Explore debates, formule preguntas y comparta experiencias sobre cientos de temas de salud.

¿Se encuentra mal?
Evalúe sus síntomas en línea de forma gratuita